Realizziamo oggi un semplice esperimento di elettrolisi dell’acqua.
Elettrolisi dell'acqua: Materiali
- Una batteria da 9 V
- Due matite temperate da entrambi i lati
- Un cartoncino dello stesso diametro del barattolo
- Un cucchiaio di bicarbonato
- Un barattolo di vetro con dell’acqua

Procedimento
Versa l’acqua nel barattolo di vetro, aggiungi il bicarbonato e mescola.



Prendi un cartoncino e ritaglia una forma cilindrica dello stesso diametro del barattolo di vetro, ricava due fori centrali sul cartoncino per le matite e ponilo sulla bocca del barattolo.
Inserisci le matite nei due fori del cartoncino, avendo cura di immergerle nella soluzione senza che tocchino il fondo del recipiente.

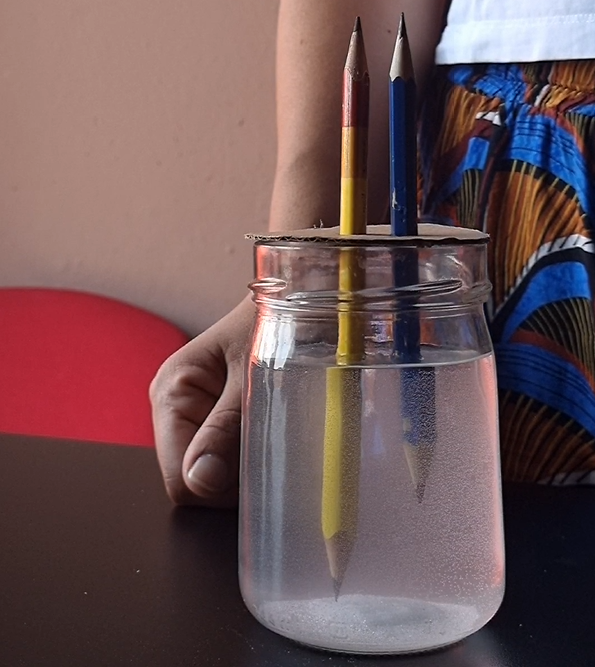
Infine, collega la batteria alle punte delle matite facendo attenzione che un polo della batteria tocchi la prima matita e l’altro la seconda.

Noterai delle bollicine che si dirigono verso la superficie e che sembrano fuoriuscire dalle punte delle matite immerse nella soluzione.
Spiegazione
Collegando la batteria alle due matite, che fungono da elettrodi, si stabilisce una differenza di potenziale: ciò permette agli ioni di muoversi facendo circolare corrente nella soluzione.
A livello chimico le molecole di acqua sono costituite da due atomi di idrogeno ed uno di ossigeno. Le molecole di acqua nell’esperimento in analisi, attraverso il processo di ionizzazione indotto dalla corrente elettrica, si scindono nelle componenti idrogeno ed ossigeno che si manifestano tramite bollicine.
L’idrogeno si raccoglierà sulla punta della matita collegata al polo negativo della batteria, mentre viceversa l’ossigeno si raccoglierà sulla punta della matita collegata al polo positivo.
Un’altra cosa da notare è che le bollicine che fuoriescono dall’elettrodo negativo (idrogeno) sono in quantità maggiore rispetto a quelle dell’elettrodo positivo questo perché ogni molecola di acqua è costituita da un atomo di ossigeno e due di idrogeno.
L’aggiunta del bicarbonato consente di aumentare la conducibilità elettrica dell’acqua, favorendo il processo di elettrolisi.
Un po' di storia e approfondimento
L’elettrolisi è un processo chimico che prevede la trasformazione di energia elettrica ad energia chimica. In molti casi, il processo si concretizza nello scomporre una sostanza negli elementi che la compongono. L’elettrolisi permette di produrre grandi quantità di sostanze gassose come cloro ed idrogeno ed è usata anche nell’industria per estrarre metalli dai minerali grezzi.
La scoperta del processo dell’elettrolisi viene attribuita ai due chimici William Nicholson e Anthony Carlysle che, nei primi anni dell’800, nel tentativo di misurare la carica delle piastre elettriche di una pila, versarono dell’acqua osservando il processo ma, solo qualche decennio più tardi, fu il fisico britannico Michael Faraday che studiò il fenomeno coniandone il termine nel 1831.
Nella pratica, le prime applicazioni del fenomeno ai processi industriali risalgono già alla fine del XIX secolo, con la costruzione dei primi impianti per la produzione di idrogeno da elettrolisi dell’acqua.
Ad oggi, il processo viene utilizzato per la produzione di cloro e soda e per la produzione di alcuni metalli come alluminio, rame e nichel. Il processo richiede per sua natura l’utilizzo di una grande quantità di energia elettrica; infatti, circa il 5% del consumo di energia elettrica per processi industriali viene utilizzata per processi di elettrolisi (qui un approfondimento).
Questo esperimento è stato svolto dalle ragazze e dai ragazzi del Servizio Civile Universale
Ti interessano altri esperimenti con l’acqua? Qui trovi molti altri esperimenti su questo tema!